La triiodotironina contro il COVID19: un nuovo studio clinico
Man mano che la malattia da COVID-19 si diffonde, il numero di pazienti in condizioni critiche che necessitano di un supporto di terapia intensiva (TI in italiano, ICU in inglese) aumenta e la mortalità è piuttosto elevata, il ché richiede nuove terapie efficaci per trattare soprattutto la sepsi e lo shock settico nei pazienti COVID-19.
Problematiche innescate dal virus
Dal punto di vista fisiopatologico, la sepsi nei pazienti con infezione virale provoca un danno cellulare dovuto sia alla replicazione virale incontrollata che all’ipossia (determinata da carenza di ossigeno).
Ipossia e infettività virale condividono le comuni vie di segnalazione pro-apoptotiche, come la proteina chinasi attivata dal mitogeno MAPK p38 (1,2).
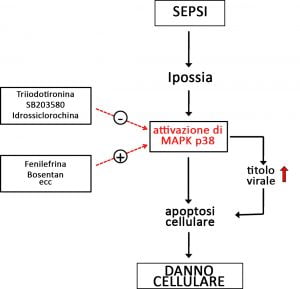
Inoltre, sostanze come gli inotropi e gli agenti vasoattivi, spesso usati nei trattamenti in terapia intensiva, possono aumentare le lesioni tissutali e il titolo virale tramite attivazione della MAPK (MAP-chinasi) p38 (1,2). Pertanto, si instaura un circolo vizioso nella sepsi virale che porta ad un’alta mortalità nonostante le attuali terapie. È stato riferito che l’uso di epinefrina e dobutamina nella sepsi è associato ad un aumento della mortalità e della fibrillazione atriale (3).
L’ormone tiroideo (TH) nella malattia acuta
In caso di malattia acuta, come la sepsi stessa, l’infarto del miocardio o un trauma, si verifica una de-regolazione del metabolismo dell’ormone tiroideo (TH), che dà vita alla sindrome da bassa T3 (NTIS), ovvero una minor concentrazione di triiodotironina circolante (T3), che si associa ad un aumento della mortalità (4).
NTIS è di rilevanza fisiologica nella difesa cellulare ed è ormai riconosciuto che il TH può aumentare la tolleranza della cellula all’ipossia attraverso la soppressione dell’attivazione della MAPK di p38, promuovendo così la riparazione dei tessuti.
Questa nuova azione riparativa del TH è attualmente analizzata nello studio ThyRepair (EudraCT: 2016-000631-40) in pazienti con STEMI (infarto acuto del miocardio) anteriore sottoposti ad angioplastica. In questo studio, quasi completato, non sono stati osservati effetti avversi importanti.
Il TH sembra anche:
- prevenire l’infettività dell’herpes simplex;
- potenziare la difesa dell’ospite aumentando le cellule natural killer (NK);
- migliorare l’effetto stimolante dell’interferone sulle cellule NK 5.
Al contrario, i corticosteroidi, che sono spesso usati nel trattamento dei pazienti in terapia intensiva, sopprimono l’infiammazione polmonare ma inibiscono anche la risposta immunitaria, dunque il loro uso rimane discutibile.
Conclusioni
Sulla base di queste prove, un nuovo studio clinico di fase II randomizzato, in doppio cieco, controllato con placebo (Thy-Support, ClinicalTrials.gov Identifier: NCT04348513) studierà l’effetto dell’alta dose endovenosa di T3 (Uni-Pharma SA, Grecia) per migliorare la fase di recupero (detta “Recovery”) di pazienti COVID-19 in condizioni critiche.
Fonti:
1. Pantos C, Mourouzis I. Translating thyroid hormone effects into clinical practice: the relevance of thyroid hormone receptor α1 in cardiac repair. Heart Fail Rev. 2015;20(3):273–82.
2. Marchant D, Dou Y, Luo H, Garmaroudi FS, McDonough JE, Si X, et al. Bosentan enhances viral load via endothelin-1 receptor type-A-mediated p38 mitogen-activated protein kinase activation while improving cardiac function during coxsackievirus-induced myocarditis. Circ Res. 2009;104:813–21.
3. Sato R, Ariyoshi N, Hasegawa D, Crossey E, Hamahata N, Ishihara T, et al. Effects of inotropes on the mortality in patients with septic shock. J Intensive Care Med 2019:885066619892218. doi: https://doi.org/10.1177/0885066619892218.
4. Padhi R, Kabi S, Panda BN, Jagati S. Prognostic significance of nonthyroidal illness syndrome in critically ill adult patients with sepsis. Int J Crit Illn Inj Sci. 2018;8:165–72.
5. Varedi M, Moattari A, Amirghofran Z, Karamizadeh Z, Feizi H. Effects of hypo- and hyperthyroid states on herpes simplex virus infectivity in the rat. Endocr Res. 2014;39:50–5.