Indice
Il pH è un concetto fondamentale nell’ambito della chimica e della biologia, ma spesso suscita curiosità e domande. Cosa significa esattamente questo termine? Come viene misurato e quale ruolo svolge nel nostro corpo e nell’ambiente circostante?
In questo articolo lo esploreremo in modo approfondito, scoprendo la sua definizione, la scala di misurazione, l’importanza nel corpo umano, i meccanismi di regolazione e gli effetti dei suoi squilibri.
Definizione di pH
Con “pH” si intende una misura che indica il grado di acidità o alcalinità di un composto. L’acronimo deriva dalla parola “potenziale di idrogeno” e rappresenta la concentrazione degli ioni idrogeno (H+) presenti in una soluzione.
È una misura critica per il mantenimento dell’equilibrio fisiologico, che non si applica solo alle soluzioni acquose, ma può essere estesa anche ad altri contesti, come al suolo, al sangue, agli alimenti e ai fluidi corporei.
La sua regolazione è fondamentale per il corretto funzionamento delle cellule e degli organismi viventi. Molte reazioni chimiche all’interno del corpo richiedono un ambiente con un pH specifico per avvenire in modo efficace.
Quando non è bilanciato può influire negativamente sulla salute e sul benessere. Gli squilibri acido-base portano a condizioni come l’acidemia (aumento dell’acidità nel sangue) o l’alcalemia (aumento dell’alcalinità nel sangue), che possono compromettere le funzioni metaboliche e fisiologiche.
Scala del pH
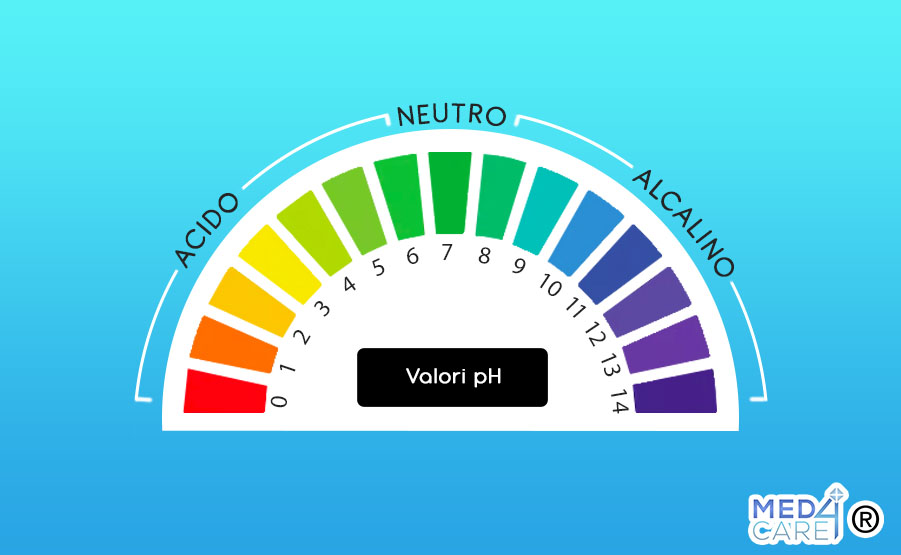
La scala di misurazione del pH va da 0 a 14, con valori specifici che corrispondono a diverse caratteristiche acido-base:
- Un valore inferiore a 7 indica una soluzione acida. A mano a mano che il valore diminuisce, la soluzione diventa sempre più acida.
- Un valore pari a 7 indica una soluzione neutra. Questo significa che non è né acida né alcalina, ma equilibrata, come ad esempio l’acqua pura.
- Un valore superiore a 7 indica una soluzione alcalina o basica. A mano a mano che il valore del pH aumenta, la soluzione diventa sempre più alcalina. Ad esempio, una soluzione con pH 8 è leggermente alcalina, mentre una soluzione con pH 14 è estremamente alcalina.
La scala è logaritmica, il che significa che ogni unità di variazione rappresenta un cambio di 10 volte nella concentrazione degli ioni idrogeno (H+) nella soluzione. Ad esempio, una soluzione con pH 3 è 10 volte più acida di una soluzione con pH 4 e 100 volte più acida di una soluzione con pH 5.
È importante notare che la scala è inversa alla concentrazione degli ioni idrogeno. Pertanto se il valore numerico è basso indica che la concentrazione è maggiore.
È stata sviluppata dal chimico danese Søren Peder Lauritz Sørensen nel 1909 per semplificare la misurazione dell’acidità delle soluzioni, ed è ampiamente utilizzata in vari campi scientifici. La determinazione accurata del pH è fondamentale in molti contesti:
- in chimica può influenzare la velocità delle reazioni chimiche e la solubilità delle sostanze;
- in biologia è essenziale per il corretto funzionamento degli enzimi e delle proteine, nonché per il mantenimento di un ambiente cellulare adatto alla vita;
- nell’industria alimentare è un fattore critico per la conservazione e la sicurezza degli alimenti.
Importanza del pH nel corpo umano
Il suo ruolo nel corpo umano è fondamentale, poiché influisce su molte funzioni fisiologiche cruciali. Il mantenimento di un equilibrio acido-base ottimale è essenziale per il corretto funzionamento delle cellule, dei tessuti e degli organi. Vediamo i principali sistemi in cui ricopre una funzione significativa:
- Sistema sanguigno: il sangue umano ha un pH leggermente alcalino, compreso tra 7,35 e 7,45. Questo intervallo ristretto è mantenuto con estrema precisione dal corpo, poiché anche lievi variazioni possono avere conseguenze significative sulla salute. Ad esempio, un valore troppo basso può interferire con l’attività enzimatica e la funzione cellulare, portando a sintomi come affaticamento, confusione mentale e aritmie. D’altra parte, se troppo alto può causare iperattività neuromuscolare, formicolio, crampi muscolari e, in casi estremi, convulsioni.
- Funzionamento di organi specifici: ad esempio, lo stomaco ha un ambiente altamente acido (pH inferiore a 3) che favorisce la digestione degli alimenti e la distruzione di batteri nocivi. L’intestino tenue, d’altra parte, è leggermente alcalino (pH > 7) per consentire l’assorbimento ottimale dei nutrienti.
- Struttura e funzione delle proteine nel corpo: le proteine sono molecole essenziali coinvolte in una vasta gamma di processi biologici, come il trasporto delle sostanze, la comunicazione cellulare e la difesa immunitaria. Un pH non bilanciato può alterarne la forma e la funzione, compromettendone l’efficacia.
- Regolazione degli enzimi: sono proteine specializzate che catalizzano reazioni chimiche all’interno del corpo e richiedono un ambiente specifico per svolgere le loro funzioni in modo ottimale. Deviazioni significative possono influenzare l’attività enzimatica e, di conseguenza, il corretto svolgimento dei processi biochimici nel corpo.
Regolazione del pH e dell'acidità nel corpo umano
Si tratta di un processo complesso che coinvolge diversi meccanismi per mantenere l’equilibrio acido-base ottimale, tra cui:
- Sistema tampone: è il sistema principale, che include una combinazione di sostanze chimiche che agiscono come “ammortizzatori” per neutralizzare gli eccessi di acidi o basi nel corpo, assorbendo gli ioni idrogeno o idrossido. Il sistema tampone bicarbonato-carbonato è uno dei più importanti per la regolazione a livello sanguigno. Il bicarbonato funge da tampone alcalino e quando il pH del sangue aumenta, accoglie gli ioni idrogeno in eccesso per ridurre l’alcalinità. Al contrario, quando diminuisce il carbonato accoglie gli ioni idrogeno per ridurre l’acidità.
- Reni: svolgono un ruolo cruciale nella regolazione, eliminando gli ioni idrogeno in eccesso attraverso l’urina. Sono in grado di regolare la quantità di ioni idrogeno escreti, aumentandone o riducendone l’escrezione in risposta a un pH sanguigno basso, e quella del bicarbonato riassorbito.
- Sistema respiratorio: i polmoni, attraverso la respirazione, regolano la concentrazione di anidride carbonica nel corpo, un prodotto di scarto del metabolismo cellulare che può formare acido carbonico quando reagisce con l’acqua nel sangue. I polmoni aumentano o diminuiscono la ventilazione per espellerla o trattenerla, influenzando così il pH sanguigno.
- Sistema renina-angiotensina-aldosterone: questo sistema endocrino è coinvolto nella regolazione della pressione sanguigna e del volume di liquidi corporei, ma può anche influenzare il pH. L’angiotensina II, una sostanza prodotta nel processo, può stimolare l’escrezione di ioni idrogeno attraverso i reni, contribuendo alla regolazione.
L’equilibrio acido-base nel corpo può essere influenzato da vari fattori, tra cui l’alimentazione, l’esercizio fisico, lo stress e alcune condizioni mediche. In situazioni in cui si verifica un grave squilibrio acido-base, come l’acidosi metabolica o l’alcalosi, possono essere necessari interventi medici specifici per ripristinare l’equilibrio. Questi possono includere l’uso di farmaci, la terapia di sostituzione di fluidi e elettroliti, o trattamenti mirati per le condizioni sottostanti.
Effetti degli squilibri del pH: acidemia e alcalemia
Tanto l’acidemia quanto l’alcalemia possono causare una serie di effetti negativi sulla salute e sul benessere, che dipendono dalla loro gravità e durata:
- Effetti sul sistema nervoso: possono causare sintomi come confusione mentale, irritabilità, stanchezza e disturbi del sonno. In casi gravi, possono verificarsi convulsioni.
- Problemi cardiovascolari: l’acidemia può causare una diminuzione della forza di contrazione cardiaca e una riduzione della capacità di pompare sangue, mentre l’alcalemia può aumentare l’irritabilità del tessuto cardiaco e portare a disturbi del ritmo cardiaco.
- Effetti respiratori: l’acidemia può provocare un aumento della frequenza respiratoria (iperventilazione) come meccanismo compensatorio per eliminare anidride carbonica in eccesso, mentre l’alcalemia, al contrario, può ridurla.
- Problemi digestivi: l’acidità eccessiva nello stomaco può causare disturbi come bruciore, indigestione e ulcere gastriche. Allo stesso tempo, un ambiente troppo alcalino può influenzare la digestione dei cibi e la distruzione di batteri patogeni.
- Effetti sulle ossa e sui muscoli: il corpo può rispondere all’acidemia cronica prelevando calcio dalle ossa per tamponare l’acido. Ciò può aumentare il rischio di osteoporosi e indebolire i muscoli.
- Problemi renali: un eccesso di acidità può causare un aumento dello stress sui reni e un’alterata escrezione di sostanze acide. Al contrario, l’alcalemia può influenzare la loro capacità di riassorbire o eliminare sostanze come il bicarbonato.
- Effetti sul metabolismo: l’attività enzimatica può essere influenzata dalla variazione del pH, compromettendo la funzione metabolica. Ciò può avere conseguenze su processi chiave come la produzione di energia e la sintesi di molecole essenziali.
È importante sottolineare che tali squilibri possono essere causati da diverse condizioni mediche sottostanti, come l’acidosi metabolica, l’alcalosi, la malnutrizione o alcune patologie renali.
Alimenti e pH
Il corpo umano è dotato di un sistema di regolazione interno molto efficace, che mantiene l’equilibrio acido-base nel corpo indipendentemente dagli alimenti che consumiamo.
Ciò che mangiamo può influenzare questo equilibrio, poiché alcuni cibi possono avere un effetto acidificante o alcalinizzante una volta metabolizzati nell’organismo. Tuttavia il loro pH non influisce direttamente sul nostro e non determina necessariamente quello del sangue o degli organi interni.
Detto questo, ci sono alcune considerazioni generali:
- Alimenti acidi: alcuni alimenti sono considerati acidi, ad esempio gli agrumi come limoni e arance, ma una volta metabolizzati nel corpo possono contribuire all’equilibrio acido-base, poiché contengono minerali alcalinizzanti come il potassio, che aiutano a neutralizzare gli acidi nel corpo.
- Alimenti alcalini: allo stesso modo, le verdure a foglia verde come spinaci, cavoli e broccoli sono spesso considerate alcaline e forniscono anche importanti nutrienti come vitamine, minerali e antiossidanti che contribuiscono al benessere generale.
- Equilibrio nella dieta: una dieta equilibrata e bilanciata, che includa una varietà di alimenti freschi, è fondamentale per la salute generale e per contribuire a mantenere l’equilibrio acido-base nel corpo.
- Effetto sulla salute: sebbene gli alimenti stessi non influenzino direttamente il pH del corpo, una dieta squilibrata può comunque influenzare la salute generale. Ad esempio, un’eccessiva acidità può contribuire a condizioni come il reflusso acido o la formazione di calcoli renali. Allo stesso modo, un’alimentazione troppo alcalina può portare a un’assimilazione inadeguata di alcuni minerali essenziali.
Misurazione del pH nell'organismo umano
È un processo utilizzato per determinare il livello di acidità o alcalinità di una sostanza. Viene ampiamente utilizzata in diversi settori, inclusi il campo medico, la ricerca scientifica, l’industria alimentare, l’agricoltura e molti altri.
Misurazione del pH in generale
Esistono diverse modalità di misurazione del pH in generale, ma i metodi più comuni sono:
- Indicatori di pH: sostanze chimiche che cambiano colore in base al pH di una soluzione. Vengono spesso utilizzati in laboratorio o a casa e i più comuni includono la cartina tornasole, che cambia colore in presenza di acidi o basi, e le soluzioni indicatori liquide, come il fenolftaleina o il tornasole blu. Il campione viene immerso nell’indicatore e il cambio di colore viene confrontato con una scala cromatica per una misurazione approssimativa.
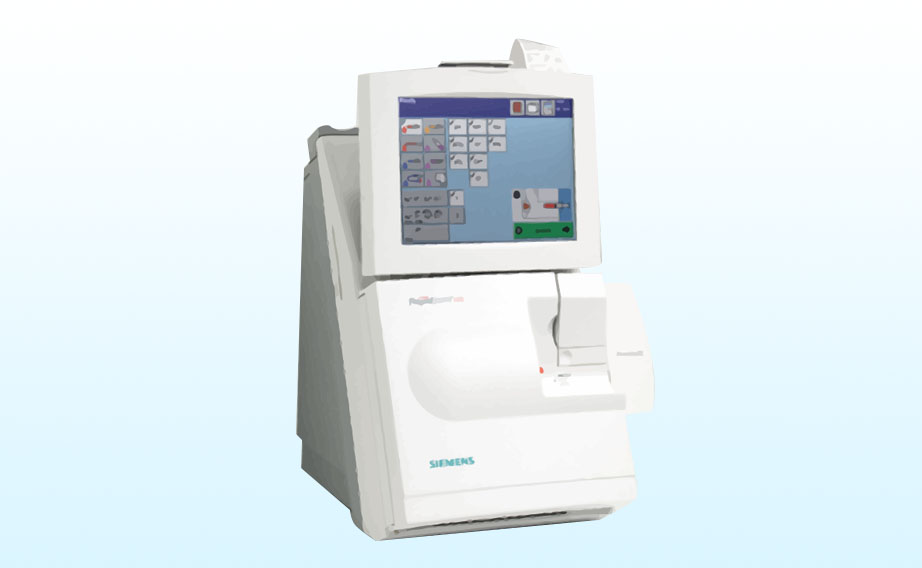
- pH-metri: sono strumenti elettronici più precisi e affidabili. Utilizzano un elettrodo di vetro che genera una differenza di potenziale elettrico in risposta al pH della soluzione in esame. Questa differenza viene misurata dai dispositivi e convertita in un valore numerico, mostrandola su uno schermo digitale in tempo reale. Sono utilizzati in laboratori scientifici, nell’industria alimentare e in ambito medico per misurazioni accurate.
- Strisce reattive: sono un altro strumento comune, facile da usare, che fornisce una stima approssimativa.
Misurazione del pH nell'organismo
Il livello di pH nel corpo umano si può misurare a partire da una sostanza prelevata dal corpo umano stesso. In genere le misure più importanti dell’acidità o alcalinità sono condotte su fluidi corporei come il sangue o le urine.
Misurazione del pH sul sangue
Il pH del sangue è un valore fondamentale per la salute del corpo. Come abbiamo visto, acidità e alcalinità estreme possono portare conseguenze significative nel nostro corpo.
Per misurare il pH del sangue in genere si esegue un prelievo di sangue, che può essere venoso o arterioso. Su di esso è possibile compiere un’insieme di esami di laboratorio che si chiama Emogasanalisi e che, oltre al pH, prevede la misura della quantità di emoglobina ossigenata, la misura dei bicarbonati e della quantità di sostanze acide o basiche presenti, e altri valori.
Approfondimento: emogasanalisi, valori misurati e parametri di riferimento
L’emogasanalisi è un insieme di esami di laboratorio che si possono compiere su un campione di sangue arterioso o venoso. Gli apparecchi per emogasanalisi non sono tutti uguali e svolgono una quantità di misurazioni diverse. Vediamo qui quali sono le misure di base svolte da quasi tutti gli apparecchi e quali sono i loro parametri di riferimento.
Vediamo in questo articolo quali sono i valori misurati all’emogasanalisi e quali sono i loro parametri di normalità.
Misurazione del pH nelle urine
Anche il pH delle urine è importante, perché riflette la capacità del rene di svolgere la propria funzione. Inoltre il pH urinario può condizionare l’eventuale capacità dei batteri di proliferare nell’urina stessa. La misura del pH è parte integrante dell’esame delle urine.
pH: informazioni da ricordare
Il pH è un concetto fondamentale che ci aiuta a comprendere l’acidità o l’alcalinità di una sostanza e il suo impatto sui processi chimici e biologici.
Dalla sua scala alle implicazioni nel corpo umano, abbiamo esplorato l’importanza di mantenere un equilibrio acido-base adeguato per la salute e il benessere.
Data la complessità dei meccanismi di regolazione nel nostro corpo, è essenziale adottare uno stile di vita sano e una dieta equilibrata per non compromettere il delicato equilibrio dell’organismo.
Sebbene i cibi che mangiamo non possano influenzarne direttamente i valori del pH, è importante preservare il più possibile i valori entro la media.